医薬部外品開発における「法定表示」とは?化粧品との違い・パッケージデザインの注意点
- 2026.02.12

この記事で分かること
- 正しい商品選択のために表示が義務付けられている「法定表示」の定義と関連諸法規
- 「医薬部外品」の文字や承認された販売名など、パッケージに必須となる記載事項
- 有効成分の分離記載など、化粧品とは根本的に異なる医薬部外品特有の表示ルール
- 審査期間を考慮した、失敗しないデザイン入稿のスケジュール管理
商品の魅力を伝えるパッケージデザインにおいて、デザイン性と同じくらい重要なのが、容器や外箱に記載される「法定表示」です。これは単なる義務ではなく、ブランドの誠実さと安全性への配慮を消費者に示すための重要な情報です。
そこで本記事では、近年ニーズが急増している「医薬部外品」の法定表示について、実務に即して詳しく解説します。
関連記事:
「化粧品」の法定表示に関してはこちら
法定表示とは?
消費者が正しい商品選択・正しい使用ができるように商品に関する情報の表示を行うよう義務付けられている表示内容です。
薬機法(医薬品医療機器等法)をはじめとした公正競争規約・PL法・消防法・景品表示法・容器包装リサイクル法など、諸法規に基づいた内容を指します。
医薬部外品とは?
医薬部外品は、一般的な化粧品と医薬品の間に位置付けられるカテゴリーです。最大の特徴は、厚生労働省が効能・効果を認めた「有効成分」を一定濃度で配合することが必須となっている点にあります。 これにより、「特定の防止・衛生(シミ予防、発毛促進他)」といった具体的な機能性を明確に訴求できるため、商品の付加価値を高め、ブランドの差別化を図る戦略的な選択肢として検討するメーカーが増えています。
実はとても幅が広く、殺虫剤やコンタクトの消毒剤も医薬部外品に含まれます。認知度が高いのは薬用化粧品や腋臭防止剤・育毛剤で、これらは薬機法上、化粧品と区別をされていても、店頭では化粧品と同じ場所に陳列され、見分けがつかないことが多いです。
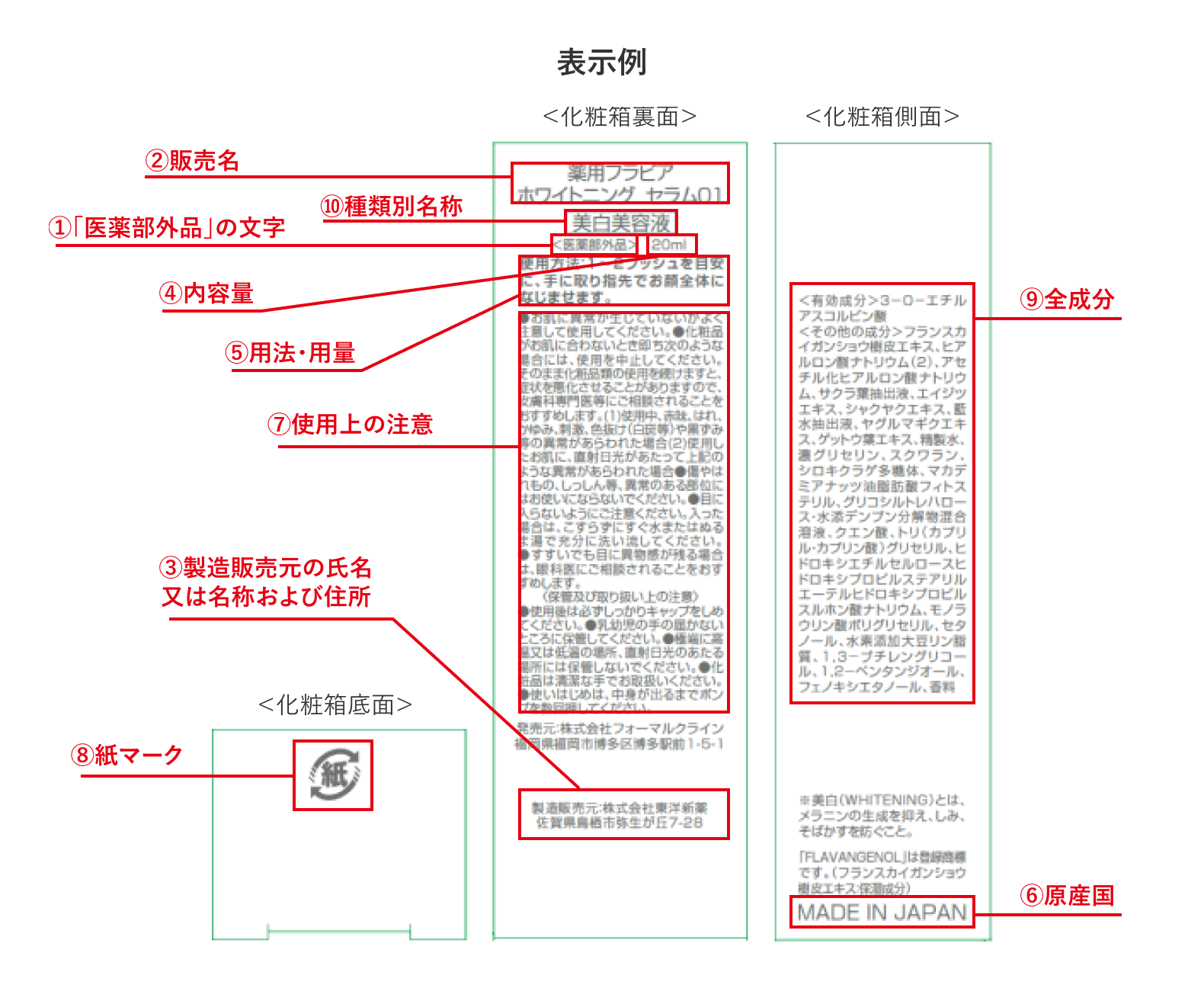
医薬部外品の法定表示の種類は?
①「医薬部外品」の文字
目立つように記載し、化粧品と誤認されないようにする必要があります。
②販売名
医薬部外品を販売するにあたり、厚生労働省へ申請し、承認を得た名称を指します。薬機法により、パッケージの目立つ場所に邦文で明瞭に記載することが義務付けられています。
一般的な「商品名」と必ずしも一致させる必要はありませんが、販売名とは別に商品名を併記する場合は、両者が同一であると誤解を与えないような表現上の配慮が求められます。
③製造販売元の氏名又は名称および住所
化粧品と同じく、医薬部外品製造販売業の許可を持つ会社が製造(元受)を行う必要があります。パッケージには、その製造販売業者の名称と、統括製造販売責任者が業務を行う住所の所在地を記載します。もし自社で製造販売業許可を持っていない場合は、OEMメーカーを製造販売元として商品化することも可能です。
ここで注意すべきは、記載する住所が必ずしも「本社」や「工場」の住所と一致するとは限らない点です。パッケージデザインを確定する前に、必ず製造販売元としての正式な名称と住所を再確認しましょう。
④内容量
容器や包装材料を含まず、内容物の量を記載します。
⑤用法・用量
承認された内容に従い、記載します。
⑥原産国
輸入品の場合に限り、記載が必要です。
⑦使用上の注意
容器や外箱などの包装資材、商品カテゴリーや配合成分に応じて、定められています。
たとえば、医薬部外品の薬用化粧品効能効果「メラニンの生成を抑え、しみ・そばかすを防ぐ」で承認された場合、以下のような文書を最外装の包装資材※へ記載する必要があります。
※最外装の包装資材は、ボトル容器を化粧箱に入れる仕様なら「化粧箱」を指します。
お肌に異常が生じていないかよく注意して使用してください。
化粧品がお肌に合わないとき即ち次のような場合には、使用を中止してください。
そのまま化粧品類の使用を続けますと、症状を悪化させることがありますので、皮膚科専門医等にご相談されることをおすすめします。
- 使用中、赤味、はれ、かゆみ、刺激、色抜け(白斑等)や黒ずみ等の異常があらわれた場合
- 使用したお肌に、直射日光があたって上記のような異常があらわれた場合
使用上の注意はデザインにおいて、比較的大きな割合を占めるため、OEMメーカーなど製造販売元へ記載事項を確認の上、パッケージデザインを進めましょう。
⑧リサイクルマーク・紙マーク
「容器包装識別表示」と呼称されます。一般消費者の分別廃棄を容易にすることが目的で、化粧品・医薬部外品に限らず、飲食物など市場に出回る消費財のほとんどに記載が必要です。
識別マークの表示箇所や大きさ・材質表示など細かく定められています。
⑨全成分(化粧品と異なる重要な法定表示)
医薬部外品と化粧品では、以下のような違いがあります。消費者の化粧品配合成分のリテラシーが高まっている今、医薬部外品開発時には、ひと工夫加えることができるポイントです。
医薬部外品: 成分を「有効成分」と「その他の成分」の2つのグループに分けて記載します。 「その他の成分」については記載順の決まりがなく、企業判断によって具体的な成分名を伏せ、配合目的(例:粘度調整剤)や成分数のみの表記に留めることも可能です。ただし、アレルギーなどの皮膚障害を起こすおそれがある「表示指定成分」については、必ず成分名を記載する義務があります。また、粧工会の自主基準では、医薬部外品であっても全成分表示の記載が推奨されていますので、「迷ったら記載する」ことをお勧めします。
化粧品: 原則として、すべての成分を配合量の多い順に記載するルールとなっています(1%以下の成分は順不同)。
⑩種類別名称(化粧品と異なる重要な法定表示)
医薬部外品では、記載は必須ではありません。しかし、消費者が一目でどのような種類の化粧品かわかるようにすることを目的に行われる表示ですので、情報提供として記載している薬用化粧品がほとんどです。
承認プロセスを考慮したデザイン・入稿のタイミング

医薬部外品を発売するには、当局の審査を経て承認を得るプロセスが必須です。審査には通常5~6ヶ月を要するため、化粧品と比較するとデザイン検討にかけられる時間的な猶予はあります。
ただし、入稿のタイミングには細心の注意が必要です。審査が進む中で、パッケージに記載する「販売名」や「使用上の注意」の内容に修正指示(指摘)が入る可能性があるためです。最終的な承認が下りるまでは、印刷データを確定させないのが実務上の鉄則です。
もし、タイトなスケジュールで医薬部外品の発売を予定する場合、医薬部外品申請ノウハウを持ったOEMメーカーと綿密に連携を取りながら、入稿タイミングを見定めましょう。
まとめ
いかがでしょうか。本記事では、医薬部外品において記載が必須となる法定表示の内容や、化粧品との具体的なルールの違いを中心に解説しました。
これ以外にも、製剤が「危険物」に該当する場合や、特定の成分配合により「使用期限」の記載が求められる場合など、製剤特有の法定表示が存在します。これらの膨大なルールをすべて漏れなく網羅することは、熟練の薬事担当者であっても、とても大変です。
東洋新薬は、長年にわたる医薬部外品開発の豊富な実績に基づき、薬機法を遵守したパッケージ制作から複雑な承認申請まで、トータルでサポートいたします。 「自社商品を医薬部外品として展開したいが、表示ルールや申請スケジュールが不安だ」とお悩みであれば、ぜひお気軽に東洋新薬までご相談ください。

東洋新薬は健康食品・化粧品業界を陰で支えるODEM(ODM&OEM)メーカーとして、世界の人々の『健康と美』への期待に『価値』で応えていくことをミッションとしています。 本サイトでは通販ビジネスにかかわるすべての皆様に様々な情報をお届けしています。
関連情報

本資料は、化粧品のOEM商品開発における「よくあるお悩み」に対して、プロである当社から具体的な解決のためのヒントをご紹介しています。
-

- 開発実績多数あり!「ルミセチル™ 薬用美白美容液OEM」の商品カタログ資料
-

- 開発実績多数あり!「メイクアップベース」の商品カタログ資料
-

- 開発実績多数あり!「ビタミンC美容液」の商品カタログ資料
-

- 東洋新薬 化粧品OEM/ODMのご案内
-

- 開発実績多数あり!「ブライトニング美容液」の商品カタログ資料
-

- 開発実績多数あり!「まつ毛美容液」の商品カタログ資料
-

- 化粧品OEM開発のお悩み解決!vol.4
-

- 化粧品OEM開発のお悩み解決!vol.3
-

- 健康食品・化粧品 商品開発専用スペース クイックラボ渋谷(QLS)開設!
-

- 化粧品OEM開発のお悩み解決!vol.2
-

- 化粧品OEM開発のお悩み解決!Vol.1
-

- OEM 商品企画~製造の流れガイド~【化粧品編】
-

- 健食・化粧品商品開発専用スペース「クイックラボ渋谷(QLS)」のご案内
-

- ルミセチル™ 薬用美白美容液
-

- メイクアップベース
-

- “純“ビタミンC美容液
-

- 美容液クレンジング
-

- 低刺激 保湿クリーム
-

- 三相乳化ノンケミUV
-

- うるおいハンドクリーム
-

- 高機能クッションファンデーション
-

- ブライトニング美容液
-

- まつ毛美容液
-

- アウトバストリートメント
-

- 化粧水
-

- リップエッセンス
-

- マルチ美容オイル
-

- ノンシリコンシャンプー
-

- クレイ配合洗顔フォーム
-

- 薬用育毛剤
-

- シワ改善保湿クリーム
-

- オールインワンジェル
-

- 高濃度炭酸パック