「保健機能食品制度」とは?
- 健康食品・サプリ記事(111)
- 関連法規(7)
- 2024.12.19

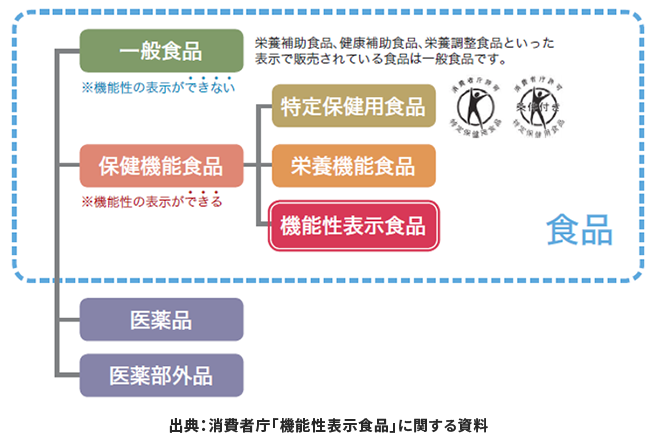
食品は、機能性の表示ができない「一般食品」と、機能性の表示ができる「保健機能食品」に分けられます。今回は、「保健機能食品」に分類される「特定保健用食品(トクホ)」「栄養機能食品」「機能性表示食品」について解説します。
- 目次
- 1.保健機能食品制度とは
- 2.保健機能食品の2024年国内市場予測は?
- 2.①特定保健用食品(トクホ)とは?
- 3.②機能性表示食品とは?
- 4-1.トクホとの違い:資料チェック
- 4-2.トクホとの違い:届出期間
- 4-3.トクホとの違い:エビデンス
- 4-4.トクホとの違い:データベース
- 4.④栄養機能食品とは?
- 5.④ニューノーマルに適した商品開発を始めませんか?
- 6.まとめ
保健機能食品制度とは
保健機能食品制度とは適切な食品表示を義務付け、消費者が安心して食生活に応じた食の選択をできるように消費者庁が創設した制度です。
この制度により、食品は「一般食品」と「保健機能食品」に分類されるようになり、「保健機能食品」のみ機能性の表示が可能となっています。 「保健機能食品」には「特定保健用食品(トクホ)」「栄養機能食品」「機能性表示食品」の3分類があり、それぞれ表示や訴求できる内容が異なります。ではここからは、保健機能食品の市場動向や3つの分類について詳しく見ていきましょう。
保健機能食品の2024年国内市場予測は?
■機能性表示食品 7,350億円(前年比107%)
■特定保健用食品 2,638億円(前年比98.1%)
機能性表示食品は、2023年にも多くの新たな届出が消費者庁から公表されており、今後も新商品の増加により、さらなる市場拡大が予想されます。一方で、「トクホ」は「機能性表示食品」との競争激化により、縮小が続いています。
①特定保健用食品(トクホ)とは?

健康の維持増進に役立つことが科学的根拠に基づいて認められ、「コレステロールの吸収を抑える」などの表示が許可されている食品です。表示されている効果や安全性については国が審査を行い、食品ごとに消費者庁長官が許可しています。
申請する製品毎にヒト試験で有効性・安全性を確認する必要があるため、開発期間は最短でも数年、開発費は最低数千万円、成分・機能性の種類によっては億円単位にもなります。申請した後も、数か月~数年かけて審査が行われ、質疑応答や、資料修正をします。しかし、そこまでの費用と時間を費やしても最悪、許可取得できない場合もあります。
しかし、再許可申請という制度もあります。これは、既許可品と全く同じ配合ならば、有効性・安全性の審査が割愛されるというものです。
東洋新薬では既にさまざまな訴求可能なトクホを開発済みですので、それを活用すれば、お客様は数十~数百万円の費用でトクホ許可を取得することが可能です。煩雑な申請書作成は当社が代行、消費者庁とのやりとりも当社がサポートします!
②機能性表示食品とは?

事業者の責任において、科学的根拠に基づいた機能性を表示した食品です。販売前に安全性及び機能性の根拠に関する情報などを消費者庁長官へ届け出たものです。ただし、トクホとは異なり、消費者庁の個別の許可を受けたものではありません。
この説明を聞いて「つまり、トクホと具体的に何が違うの?」と感じてらっしゃる方もいるでしょう。
続いて、トクホとの違いをご説明します。
トクホとの違い:資料チェック
トクホは「国のお墨付き」ですが、機能性表示食品はあくまでも「事業者責任」です。そのため、消費者庁は届出書を形式的にしかチェックしません。とはいえ、関連諸法規や届出等に関するマニュアルなど、事業者が最低限守るべき事項が守られていない場合は届出不備となり指摘を受領することになります。例えば、「表示しようとする機能性に基づく適切な記載であるか確認の上、修正してください。」や「痩身効果を標榜させるおそれはないか確認の上、必要に応じて修正してください。」などの指摘がそれにあたります。
トクホとの違い:届出期間
トクホより消費者庁の資料確認期間が短いのも特徴で、基本的に60営業日(必要と判断された場合には120営業日)以内*にチェックすることとなっています。つまり届出から60営業日(120営業日)後*には、受理or不備指摘が分かります。
*2025年4月1日以降、それ以前は60日以内
トクホとの違い:エビデンス
届出する製品毎のヒト試験が必須ではなく、機能性関与成分に関する研究レビューでも良いため、届出準備期間もトクホほどかかりません。
トクホとの違い:データベース
届け出手続きがデータベースで行われたり、受理品の情報検索データベースがある点も、トクホとは異なります。トクホ申請は紙(冊子)ですし、許可品一覧が公開されているだけで検索データベースはありません。
<機能性表示食品届出の基本的な流れ>
1. 食品関連事業者の基本情報の届出
2. ID取得(メールでIDが送られてくる)
3. 機能性表示食品制度DBにログインして、届出情報を入力&添付する。https://www.fld.caa.go.jp/certification/login_ini.do?login=KINOU4. 消費者庁からの受理連絡を待つ(受理or不備指摘のどちらでも、事業者宛に外部メールが届く)。
5. 機能性表示食品届出情報検索DBに情報公開される。
https://www.fld.caa.go.jp/caaks/cssc01/
消費者庁のチェックは届出された順で行われるため、「急いでいるため至急確認してほしい」といった要望を出しても叶いません。さらに、不備があるとやり直しとなり、再度順番待ちの列に戻ります。
受理後にパッケージデザインなどを変更する場合も、データベースで変更届を行って順番待ちとなります。こちらの確認期間の目安は提示されていませんが、2~3か月といったところです(2024年12月現在)。
変更届は、変更理由の説明や、新旧対照表を用いて変更点を説明する必要があります。こちらも不備があるとやり直しとなり、再度順番待ちの列に戻ります。
【機能性表示食品のおすすめ関連情報】
>機能性表示食品 OEM開発シリーズ① 有効性・安全性のエビデンスとは?
>機能性表示食品 OEM開発シリーズ② 関与成分とその定量分析・定性分析について
>機能性表示食品 OEM開発シリーズ③ 商品の設計と製造について
>機能性表示食品 OEM開発シリーズ④ 義務表示とパッケージ記載情報について
>機能性表示食品 OEM開発シリーズ⑤ 消費者庁への届出について
>機能性表示食品 OEM開発シリーズ⑥ 最終回・まとめ
③栄養機能食品とは?

一日に必要な栄養成分(ビタミン、ミネラルなど)が不足しがちな場合、その補給・補完のために利用できる食品です。すでに科学的根拠が確認された栄養成分を一定の基準量含む食品であれば、特に届出などをしなくても、国が定めた表現によって機能性を表示することができます。
つまり、食品にビタミンやミネラルなどを基準量配合しさえすれば、特に届け出なくとも、機能性を表示できます。
ただし、一日当たりの摂取目安量に含まれる当該栄養成分量が定められた上・下限値の範囲内にある必要があるほか、栄養成分の機能だけでなく注意喚起表示等も表示する必要があります。なお、この表現は一言一句変更NGです。

図:出典 消費者庁「栄養機能食品」に関する資料から抜粋
まとめ
いかがでしょうか。このように、保健機能食品にはレベルは違えど、さまざまな縛りがあります。
また、保健機能食品は大前提として「健康の維持・増進に役立つもの」という考えがありますので、美容や痩身はその範囲外となり、保健機能食品であるトクホ・機能性表示食品・栄養機能食品での訴求はできません。
どのようなエビデンスで、どのような訴求を行いたいかによって、保健機能食品とするか一般健食とするかが変わってきます。わからないことがあればぜひ一度、東洋新薬までご相談ください。

東洋新薬は健康食品・化粧品業界を陰で支えるODEM(ODM&OEM)メーカーとして、世界の人々の『健康と美』への期待に『価値』で応えていくことをミッションとしています。 本サイトでは通販ビジネスにかかわるすべての皆様に様々な情報をお届けしています。
関連情報

この資料では、機能性表示食品の開発において、消費者庁に届出・受理されるまでにぶつかりやすい「3つの壁」とその回避術をご紹介します。
-
1

- 「保健機能食品制度」とは?
- 健康食品・サプリ記事
- 関連法規
-
2

- 消費者庁 機能性表示食品 事後チェック指針 とは?
- 健康食品・サプリ記事
- 関連法規
-
3
- 健康食品と栄養成分表示について。消費者の関心が高い成分とは?
- 健康食品・サプリ記事
- 関連法規
-
4

- 食品表示法とは?表示が義務化された「栄養成分表示」
- 健康食品・サプリ記事
- 関連法規
-
5

- 食薬区分とは?食薬区分改正で注目の成分もご紹介!
- 健康食品・サプリ記事
- 関連法規
-

- 製剤技術「イージーパウダー®」のご紹介
-

- スタートアップ企業必見!20代~40代向け 青汁 OEM商品開発の成功ポイント
-

- 【2025年最新】食品表示における「製造所固有記号」とは?― その目的と取得の方法
-

- 開発実績多数あり!「免疫ケアタブレットOEM CRL1505乳酸菌」の商品カタログ資料
-

- Wellness Daily News 健康食品 Inside Out 大麦若葉青汁ができるまで
-

- Wellness Daily News サプリ製造の現場から 東洋新薬品質保証編/工場内部へ
-

- インドマンゴスチンエキス末のご紹介
-

- CRL1505乳酸菌のご紹介
-

- 開発実績多数あり!「インドマンゴスチン脂肪・BMIケアタブレットOEM」の商品カタログ資料
-

- 開発実績多数あり!「溶けやすいプロテイン粉末飲料OEMイージーパウダー®」の商品カタログ資料
-

- 商品開発担当者向け 機能性表示食品届出の「3つの壁」~事例から見たその回避術
-

- 開発実績多数あり!「飲みこみやすいイージータブ® ブラックジンジャーサプリメント」の商品カタログ資料
-

- 健食・化粧品商品開発専用スペース「クイックラボ渋谷(QLS)」のご案内
-

- OEM 商品企画~製造の流れガイド~【健康食品・サプリメント編】
-

- 黒ショウガエキス末のご紹介
-

- 「売れる青汁」は主原料に注目!差別化商品を生み出す5つのポイント
-

- コロナ禍で市場拡大? 市場データと事例から見る「青汁」商品開発のヒント
-

- 機能性表示食品 免疫ケアタブレットCRL1505乳酸菌
-

- 機能性表示食品 脂肪・BMIケアタブレット
-

- 溶けやすいプロテイン粉末飲料
-

- イージータブサプリメント
-

- オーラルケアタブレット
-

- 特保の青汁
-

- 機能性表示 ダイエットサプリ