機能性表示食品の「エビデンス」を解説 ~有効性・安全性の担保
- 健康食品・サプリ記事(111)
- 商品開発(56)
- 2022.04.04

今回は、機能性表示食品を開発し、消費者庁に届出をする際に求められる「有効性と安全性の科学的根拠(エビデンス)」について解説します。エビデンスが必要な理由や有効性・安全性を担保する工程などをご紹介します。
機能性表示食品 OEM開発シリーズ
「機能性表示食品を開発、販売したい!」という場合、商品開発から消費者庁への届出、製造、販売までにさまざまなステップが必要です。そこでシリーズとして、本記事以外にも機能性表示食品OEM開発のポイントを解説しているので、合わせてご確認ください。
・機能性関与成分とは?概要から分析方法まで解説
・機能性表示食品の商品開発について。設計と製造を解説
・機能性表示食品の「表示」を解説。記載義務や禁止事項とは
・機能性表示食品の「届出」を解説。事前準備から事後対応まで
*本シリーズは、消費者庁「機能性表示食品の届出等に関するガイドライン」に基づいています。
https://www.caa.go.jp/policies/policy/food_labeling/foods_with_function_claims/assets/foods_with_function_claims_230929_0002.pdf
- 目次
- 1.機能性表示食品とは?
- 2.機能性表示食品でエビデンスが必要な理由
- 2-1.そもそも「科学的根拠(エビデンス)」とは?
- 2-2.機能性表示食品にエビデンスが求められる理由や背景
- 3.機能性表示食品におけるエビデンスの「質」について
- 3-1.エビデンスの質の決定要因
- 3-2.機能性表示食品の届出時に求められるエビデンスの質
- 3-3.機能性表示食品のエビデンスの質を高めるには?
- 3-4.機能性表示食品のエビデンスの質が低い場合
- 4.機能性表示食品の「有効性」を担保するための工程
- 4-1.①最終製品を用いた臨床試験
- 4-2.②最終製品または機能性関与成分に関する研究レビュー(SR)
- 4-3.「臨床試験」と「研究レビュー(SR)」のメリット・デメリット
- 5.機能性表示食品の「安全性」を担保するための工程
- 5-1.①食経験や安全性試験に関する評価
- 5-2.②機能性関与成分などの相互作用に関する評価
- 6.まとめ
機能性表示食品とは?

機能性表示食品とは、特定の保健の目的が期待されるような機能性の表示(ヘルスクレームの表示)ができる食品のことを指します。
そもそも、食品は以下のように分類でき、機能性表示食品は「保健機能食品」に属します。一般食品や健康食品は、機能性の表示(ヘルスクレームの表示)を行うことができません。
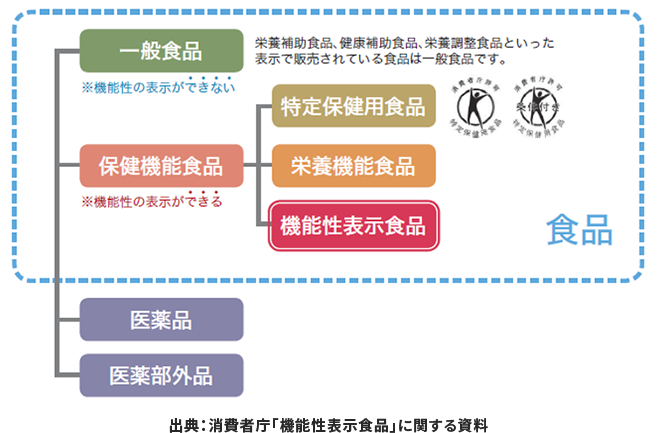
この保健機能食品のうち「特定保健用食品(トクホ)」では、国が個別に審査・許可したヘルスクレーム表示が可能です。また、「栄養機能食品」では、国の規格基準に従ってビタミン・ミネラルなどのヘルスクレーム表示のみができます。
しかし、「機能性表示食品」は上記の2つとは異なり、国ではなく事業者自らの責任において、エビデンスを基にしたヘルスクレーム表示をすることができる制度となります。トクホでは認められていない、「睡眠」「ストレス」「血管の柔軟性」などのヘルスクレーム表示をすることが可能です。ただし、商品として販売する前に、国の定めるルールに基づき食品の機能性、つまり有効性と安全性に関する科学的根拠(エビデンス)などの必要事項を事業者が消費者庁に提出し、審査を受ける必要があります。
そのため、機能性表示食品を開発する際は、事業者自らがエビデンスとして有効性と安全性の両方を担保する必要があるのです。
機能性表示食品でエビデンスが必要な理由
そもそも「科学的根拠(エビデンス)」とは?

Wikipediaには「科学的証拠または科学的根拠(Scientific evidence)は、科学的理論や仮説を支持したり反論したりする働きをする証拠である」とあります。科学的根拠とは文字通り「ある事柄・主張を裏付ける根拠であり、かつそれが科学的な性質を帯びているもの(すなわち実験や観察などによって検証されているもの)」と考えられます。
機能性表示食品にエビデンスが求められる理由や背景
機能性表示食品にエビデンスが求められる理由や背景について、さらに確認していきましょう。機能性表示食品のガイドラインには、機能性表示食品である条件として、下記のような記載があります。
“機能性表示食品は、食品表示法(平成25年法律第70号)第4条第1項の規定に基づく食品表示基準(平成27 年内閣府令第10号)第2条第1項第10号に規定する安全性及び機能性に関する一定の科学的根拠に基づき、食品関連事業者の責任において特定の保健の目的が期待できる旨の表示を行うものとして、消費者庁長官に届け出られたものである。”
つまり、機能性表示食品は、商品の機能性(=有効性)と安全性が科学的根拠に基づいていることが前提条件として求められていることがわかります。では、なぜ食品の効果・効能を表示するために科学的根拠が必要なのでしょうか?
例えば、健康食品が持つ価値について、消費者は主に広告や宣伝の内容から、判断することになります。しかし健康食品は食品という性質上、その価値(効果・効能)が広告内容通りなのかを確認するには、購入・摂取しなければいけません。場合によっては、消費者が考えていた価値と、実際の価値に乖離が発生し、問題となることもあります。
その際、その商品が持つ価値を客観的に裏付ける根拠があれば、消費者はその情報をもとに、商品が持つ価値を正しく判断することができますが、その客観的な根拠としてよく利用されるのが「科学的根拠」です。実験や観察による学術的な検証が求められるという性質上、販売する側の主観が介入しにくく、ある程度の客観性が保たれるためです。
そのため、「機能性表示食品を販売するにあたって、なぜ科学的根拠が必要なのか」という問いに対する回答としては、狭義では、「機能性表示食品を届出・販売するのに必要」ということになりますが、本質的な意義を考えると、「消費者のより適切な商品選択に資するため」と言えるでしょう。
機能性表示食品におけるエビデンスの「質」について

エビデンスの「質」の決定要因
では、ここでエビデンスにおける「質」について、考えてみましょう。
エビデンスの質は、研究の試験方法や刊行物としての種類(社内報告書、論文、レビューなど)、研究実施者の利益相反(被験者や原料メーカーとの利害関係など)などによって決まります。
研究の試験方法は、以下のような観点になります。
・偽薬と効果の比較を行っている/いない
・被験者や試験実施者は、偽薬又は試験食品どちらを摂取したのか明らかにしている/いない
・被験者の群分けは無作為に行っているのか
・どのような性質の被験者をどの程度の規模で行った試験なのか など
以上のような項目があり、その項目ごとにも質の高低があります。
機能性表示食品の届出時に求められるエビデンスの質
では、機能性表示食品の届出時に提出するエビデンスについて、どの程度の質が求められるのでしょうか?
機能性表示食品のガイドラインの中で、必要な科学的根拠の最低限の基準が明記されているため、最低限の基準はクリアする必要があります。ガイドライン記載の基準を満たさない科学的根拠を使用した届出はできず、仮に届出公開となってもその後、撤回リスクがつきまといます。
とはいえ、最低限の科学的根拠があれば問題ないかといえば、必ずしもそうではありません。
2020年3月に公開された「事後チェック指針」(正式名称:機能性表示食品に対する食品表示等関係法令に基づく事後的規制(事後チェック)の透明性の確保等に関する指針)には、このような記載があります。
“新たな科学的知見により、届出された根拠資料が科学的な合理性を欠くこととなることが判明した場合には、食品表示基準に規定する機能性表示食品の要件を満たさなくなるため、ガイドラインに基づき速やかに届出の撤回を行う必要があるとともに、景品表示法上問題となるおそれが生じ得るが、当該事象を速やかに把握し、当該撤回の対応を速やかに行った限りにおいて、景品表示法上問題となるものとは取り扱わない。”
つまり、「研究レビューを作成し、それをもとに届出・販売となった後に、機能性関与成分に関するネガティブな論文が出された場合、すぐに修正すれば景品表示法上の問題として扱わない」ということです。逆に言えば、研究レビューは実施したのみで終わりではなく、事業者は、届出した研究レビューについて、最新の知見を踏まえて問題ないかの定期的なチェックの責任が求められるということです。
機能性表示食品のエビデンスの質を高めるには?
研究レビューの結論は「totality of evidence(採用文献全体を見て、総合的に肯定的といえるかどうかを判断)」の考えのもと行うため、より質の高いポジティブな結果の文献を採用文献としていれば、新たにネガティブな知見が出てきても、それによって結論が覆されるリスクは小さくなります。
逆に言うと、質の低いネガティブな結果の文献を採用した場合、研究レビューの結論に覆される可能性が当然高くなります。これは商品を販売する上でのリスクに繋がるため、販売に力を入れたい商品ほど、より質の高い科学的根拠を用意するのが望ましいと考えられます。
機能性表示食品のエビデンスの質が低い場合
「質の低い科学的根拠」とは、「その食品に効果があると言える根拠が薄弱」ということです。つまり、質の高い厳密な試験を行った場合に効果が得られない可能性も高いといえ、本来効果を有さない成分です。それにもかかわらず、「〇〇の機能があります」と訴求して販売していた場合、消費者を欺くことになります。
近年、企業の社会的責任への関心が高まっている事も考慮すると、事業者は科学的根拠の質に対して、自らもっと厳しい目で見る責任を有すると考えられます。更に言えばOEM企業選定時にも、この「科学的根拠」に対して厳しい基準を有する企業がパートナーとして相応しいでしょう。
機能性表示食品の「有効性」を担保するための工程

上述したように、機能性表示食品を開発する際は、事業者自らがエビデンスとして、有効性と安全性の両方を担保する必要があります。
この章では、有効性を評価する手法を解説します。有効性評価として①最終製品を用いた臨床試験、②最終製品または機能性関与成分に関する研究レビュー(SR) の、いずれかの手法を用いる必要があります。
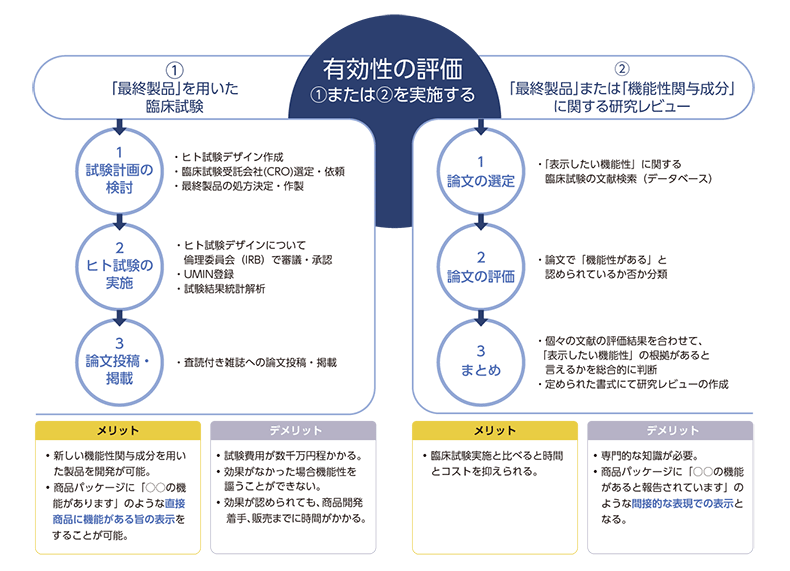
①最終製品を用いた臨床試験
臨床試験では、ヒトを対象として食品の「有効性」を確認します。おおよその手順は、以下の通りです。
1) 試験計画の検討:
機能性表示食品ガイドラインやトクホに準拠した方法でのヒト試験デザイン(被験者の属性や人数、試験食品やその摂取期間、評価項目など)を検討します。試験自体は第三者機関で実施する必要があり、通常はCROとよばれる「臨床試験受託会社」に依頼する必要があります。また、試験食品として実際に届出を行う最終製品を用いるため、ヒト試験の実施までに処方の決定および作成が必要となります。
2)ヒト試験の実施:
試験デザインの内容を倫理委員会(IRB)で審議・承認後、UMIN (University Hospital Medical Information Network:大学病院医療情報ネットワーク)への登録を行います。その後、実際に試験実施となります。ヒト試験の結果を解析し、期待していた有効性の効果が統計学的に有意に認められるかどうか確認します。
3)論文投稿・掲載:
有効性の効果が認められた場合、その解析結果をまとめ、査読付き雑誌への論文投稿・掲載までの対応を行います。
②最終製品または機能性関与成分に関する研究レビュー(SR)
「研究レビュー」(システマティックレビュー、SRとも呼ばれています)は、一定のルールに基づき世の中にある文献を網羅的に検索し、総合的に評価を行い、体系的にまとめたものになります。
おおよその手順は、以下の通りです。
1)事前に決定した手順に従い、論文を選別:
「表示したい機能性」に関する臨床試験の文献を、データベースを用いて検索します。ヒットした論文から、関連がある文献を抽出します。なお、結果がポジティブ/ネガティブに関わらず、関連があるものはすべて採用しなければなりません。
2)各論文の質を踏まえ、総合的観点から機能性を科学的に評価:
抽出した論文を精査し、最終製品または機能性関与成分に「機能性がある」と認められているか否かを分類します。また、抽出した論文の質(論文に記載された研究の試験方法や刊行物としての種類、研究実施者の利益相反等)についても評価を行います。
3)評価のプロセスと結果のまとめ:
個々の文献の評価結果を合わせて、「表示したい機能性」の根拠があると言えるかを総合的に検討し、判断します。研究レビューとして定められた書式に論文の検索方法やその結果、抽出された論文の質などをすべてまとめ、総合的に機能性の有無を結論付けます。
「臨床試験」と「研究レビュー(SR)」のメリット・デメリット
臨床試験のメリット・デメリット
試験の実施には費用が数千万円程かかります。効果が認められなければその食品で機能性表示を謳うことはできません。結果が良くても試験実施~論文化までのタイムラグもあるため、この工程だけでも1年程度の長い時間がかかります。
一方、この工程を経ることでまだ世に出ていない新たな機能性関与成分を用いた商品の開発が可能となります。また、実際に届出・販売する商品を用いて実施するため、商品パッケージに「○○機能があります」といった表示が可能になります。
研究レビュー(SR)のメリット・デメリット
研究レビューはすでにある論文などをもとに作成するため、臨床試験と比べて時間もコストも抑えられる一方、専門的な知識が必要です。
また、研究レビューでは臨床試験と異なり、実際の商品の評価ではなく、総合的に評価した結果をもとにエビデンスが示されているため、商品パッケージには「○○の機能があると報告されています」といった、間接的な表現での表示が基本となります。
 有効性評価フローおよびメリット・デメリット
有効性評価フローおよびメリット・デメリット
機能性表示食品の「安全性」を担保するための工程

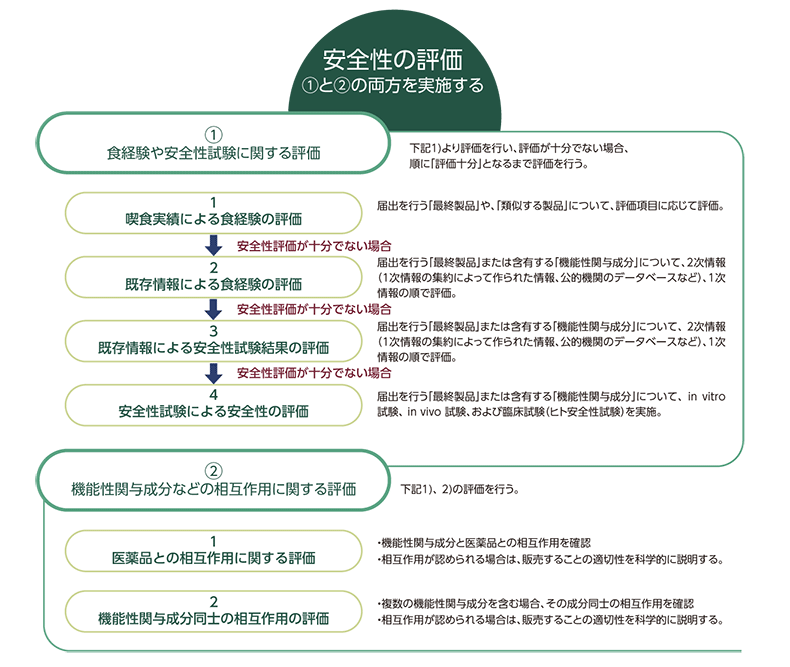
機能性表示食品のエビデンスにおける有効性と安全性のうち、この章では安全性を評価する手法を解説します。安全性評価のエビデンスを担保するためには、①食経験や安全性試験に関する評価、②機能性関与成分等の相互作用に関する評価を行う必要があります。
①食経験や安全性試験に関する評価
食経験や安全性試験に関する評価については、以下4項目のいずれかで評価十分となるよう説明する必要があります。上位の項目で「評価十分」とできた場合も、次項目以降の評価を行っても問題ありません。
1)喫食実績による食経験の評価:
届出を行う最終製品や類似する製品について、摂取する集団やその形状・方法・頻度、機能性関与成分の摂取量や含有量、販売期間やその量、健康被害情報といった項目で、喫食実績の評価を行います。
2)既存情報による食経験の評価:
1)での評価が不十分な場合には、機能性関与成分又は最終製品の食経験について、まず2次情報(1次情報の集約によって作られた情報、公的機関のデータベースなど)の内容を確認し、内容が不十分であった場合、1次情報(文献検索)により評価を行います。
3)既存情報による安全性試験結果の評価:
1)、2)の食経験の評価ができない場合、または届出をしようとする食品の摂取量がこれまでの喫食実績における摂取量よりも増加する場合など食経験の評価のみでは安全性が十分とはいえない場合は、機能性関与成分における安全性試験の既存情報として、まず2次情報による調査を行い、内容が不十分であった場合、1次情報の調査を行います。
4)安全性試験による安全性の評価:
3)では安全性が十分に評価できない場合は、原則として、in vitro 試験、 in vivo 試験、および臨床試験(ヒト安全性試験)を実施します。
②機能性関与成分などの相互作用に関する評価
機能性関与成分などの相互作用に関する評価については、下記2項目について実施する必要があります。
1) 医薬品との相互作用に関する評価:
機能性関与成分と医薬品の相互作用の有無を確認し、相互作用が認められる場合は、販売することの適切性を科学的に説明する必要があります。
2)機能性関与成分同士の相互作用の評価:
届出を行う最終製品に複数の機能性関与成分が含まれる場合、医薬品との相互作用の有無の確認に加えて、その成分同士の相互作用の有無を確認し、相互作用が認められる場合は、販売することの適切性を科学的に説明する必要があります。
 安全性評価フロー
安全性評価フロー
まとめ
いかがでしょうか。今回は、機能性表示食品のエビデンス、そして「有効性・安全性」を担保する工程について解説しました。
機能性表示食品を開発する上で、エビデンスを明らかにすることは非常に重要であり、明らかにするだけでなく質を担保することも必要です。
東洋新薬には経験豊かな専門チームと豊富な届出実績があり、既存の機能性関与成分やヘルスクレームを活用する商品開発や届出のサポートはもちろん、新規ヘルスクレーム開発のためのエビデンス取得・届出までのフルサポートが可能です。
機能性表示食品のOEM開発・届出でお困りごとがありましたら、ぜひ一度、東洋新薬にご相談ください。
参考文献:消費者庁 機能性表示食品の届出等に関するガイドライン
https://www.caa.go.jp/policies/policy/food_labeling/foods_with_function_claims/assets/foods_with_function_claims_230929_0002.pdf

東洋新薬は健康食品・化粧品業界を陰で支えるODEM(ODM&OEM)メーカーとして、世界の人々の『健康と美』への期待に『価値』で応えていくことをミッションとしています。 本サイトでは通販ビジネスにかかわるすべての皆様に様々な情報をお届けしています。
関連情報

この資料では、機能性表示食品の開発において、消費者庁に届出・受理されるまでにぶつかりやすい「3つの壁」とその回避術をご紹介します。
関連記事
-
1

- 機能性関与成分とは?概要から分析方法まで解説
- 健康食品・サプリ記事
- 商品開発
-
2
- オーラルケアOEM特集!企画~製造~開発のヒントを一挙ご紹介
- 健康食品・サプリ記事
- 商品開発
-
3

- 注目の高まる女性向けプロテイン ~商品開発のヒント
- 健康食品・サプリ記事
- 商品開発
-
4

- 青汁OEM販売までの4ステップ~費用やロット数にも注意!
- 健康食品・サプリ記事
- 商品開発
-
5

- 機能性表示食品の研究レビューを解説。届出資料作成上のポイント
- 健康食品・サプリ記事
- 商品開発
-

- 製剤技術「イージーパウダー®」のご紹介
-

- スタートアップ企業必見!20代~40代向け 青汁 OEM商品開発の成功ポイント
-

- 【2025年最新】食品表示における「製造所固有記号」とは?― その目的と取得の方法
-

- 開発実績多数あり!「免疫ケアタブレットOEM CRL1505乳酸菌」の商品カタログ資料
-

- Wellness Daily News 健康食品 Inside Out 大麦若葉青汁ができるまで
-

- Wellness Daily News サプリ製造の現場から 東洋新薬品質保証編/工場内部へ
-

- インドマンゴスチンエキス末のご紹介
-

- CRL1505乳酸菌のご紹介
-

- 開発実績多数あり!「インドマンゴスチン脂肪・BMIケアタブレットOEM」の商品カタログ資料
-

- 開発実績多数あり!「溶けやすいプロテイン粉末飲料OEMイージーパウダー®」の商品カタログ資料
-

- 商品開発担当者向け 機能性表示食品届出の「3つの壁」~事例から見たその回避術
-

- 開発実績多数あり!「飲みこみやすいイージータブ® ブラックジンジャーサプリメント」の商品カタログ資料
-

- 健食・化粧品商品開発専用スペース「クイックラボ渋谷(QLS)」のご案内
-

- OEM 商品企画~製造の流れガイド~【健康食品・サプリメント編】
-

- 黒ショウガエキス末のご紹介
-

- 「売れる青汁」は主原料に注目!差別化商品を生み出す5つのポイント
-

- コロナ禍で市場拡大? 市場データと事例から見る「青汁」商品開発のヒント
-

- 機能性表示食品 免疫ケアタブレットCRL1505乳酸菌
-

- 機能性表示食品 脂肪・BMIケアタブレット
-

- 溶けやすいプロテイン粉末飲料
-

- イージータブサプリメント
-

- オーラルケアタブレット
-

- 特保の青汁
-

- 機能性表示 ダイエットサプリ